創(chuàng)新藥物的開發(fā)是一個極具探索性的研究過程,其通常由未知開始,基于未被滿足的臨床需求��,去開展藥物篩選與發(fā)現(xiàn)的工作�����。不同于仿制藥���,創(chuàng)新藥物的研究,是隨著不同階段而逐步深入展開的,每階段研究的深度通常會對應(yīng)著相應(yīng)的審評嚴寬程度���,從而避免不必要的過度開發(fā)��,以節(jié)約各方面的資源����。在我國�����,創(chuàng)新藥物的開發(fā)�����,雖起步較晚且尚不成熟��,但整體趨勢正在追趕歐美日�,每個環(huán)節(jié)細節(jié)也都在完善當中,如下面要聊的IND申請中的“藥學研究”�,就是其中之一。
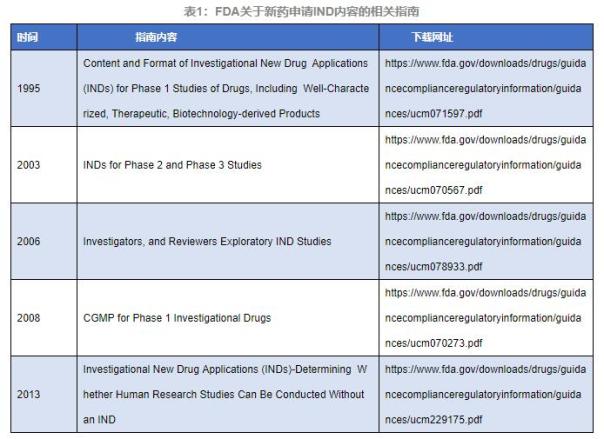
1. FDA關(guān)于IND階段藥物的審評指南
早在1995年�����,美國食品藥品監(jiān)督管理局的CDER和CBER便發(fā)布了關(guān)于IND階段的藥物指南“Content and Format of Investigational New Drug Applications (INDs) for Phase 1 Studies of Drugs, Including Well-Characterized, Therapeutic, Biotechnology-derived Product”,該指南闡明了21 CFR中312.22和312.23關(guān)于最初進入美國臨床研究試驗藥物的數(shù)據(jù)要求����,允許IND階段提交的各種研究的數(shù)據(jù)及深度,具有極大的靈活性�。
2003年,F(xiàn)DA又發(fā)布了指南“INDs for Phase 2 and Phase 3 Studies”��,該指南進一步提供申請人(IND階段)關(guān)于II期/III期臨床化學��、生產(chǎn)���、CMC信息等內(nèi)容的相關(guān)建議和要求�����。
2008年,F(xiàn)DA發(fā)布指南“CGMP for Phase 1 Investigational Drugs”���,該指南詳細闡述了Ⅰ期臨床試驗樣品生產(chǎn)落實cGMP的問題����,建議采用藥物質(zhì)量控制(QC)原則作為cGMP的一部分���,從而保證Ⅰ期臨床試驗樣品的質(zhì)量和安全性�。
2013年,F(xiàn)DA再次發(fā)布指南“Investigational New Drug Applications (INDs) - Determining Whether Human Research Studies Can Be Conducted Without an IND”����,該指南旨在幫助臨床申請人確定新藥IND申請下,涉及相關(guān)的研究是否必須被研究���,如21 CFR 312部分�;并詳細說明了何時需要IND申請�����,何種情況不需要IND申請���,確定了一定的適用范圍����。
2. IND藥學部分-分塊細述
根據(jù)美國FDA發(fā)布的相關(guān)指南的詳細內(nèi)容�����,在不同臨床申報階段����,其對創(chuàng)新藥物-藥學部分的原料藥��、穩(wěn)定性��、質(zhì)量��、制劑等內(nèi)容���,具有詳細的分段研究要求,詳情如下:
☆原料藥部分
☆☆I(lǐng)期臨床
制備工藝~提供合成工藝研究的簡要總結(jié)���,說明現(xiàn)有試制規(guī)模���,合成路線圖中建議明確各步驟的反應(yīng)條件、所用試劑��、溶劑��、催化劑等����,建議開始關(guān)注對關(guān)鍵起始原料的質(zhì)量數(shù)據(jù)積累�;因精制工藝的不同可能影響產(chǎn)品的雜質(zhì)譜�����、晶型�����、粒度等���,需注意說明粗品的純化/精制方法。
特性鑒定~此階段提供支持化學結(jié)構(gòu)的初步研究數(shù)據(jù)即可����;說明可能影響安全性的理化性質(zhì),如溶解性(不同pH溶液中)�、粒度、晶型等���。建議在早期臨床階段即確定藥用晶型�,但粒度還需要結(jié)合臨床研究的推進不斷積累數(shù)據(jù)��。
☆☆I(lǐng)I/III期臨床
制備工藝~提交制備工藝的變化及相關(guān)研究資料����,評估變更對產(chǎn)品的質(zhì)量和安全性的影響����;對于保證產(chǎn)品安全性的生產(chǎn)步驟(如發(fā)酵產(chǎn)物的純化步驟)的過程控制應(yīng)有清晰描述����;提供起始原料的質(zhì)量控制信息(來源、分析方法�����、檢測結(jié)果)�����,對于結(jié)構(gòu)復雜的關(guān)鍵起始原料應(yīng)提供詳細生產(chǎn)工藝信息����;提供關(guān)鍵步驟、中間體的控制信息�����。
特性鑒定~提供合理支持藥物化學結(jié)構(gòu)的證明����,單晶X衍射、構(gòu)象分析等可在III期提供����;結(jié)合臨床試驗制劑的劑型特點和藥物特性,提供進一步完善的原料藥理化性質(zhì)信息����,包括溶解性、晶型����、粒度、滲透性����、旋光性、引濕性����、分配系數(shù)、電離常數(shù)等�����,對于口服固體制劑,建議盡早研究其原料藥的滲透性�,了解其BCS分類,對制劑處方工藝開發(fā)以及體外釋放方法的建立很有幫助�。
☆穩(wěn)定性研究
☆☆I(lǐng)期臨床
提供已有的穩(wěn)定性試驗結(jié)果、后續(xù)的穩(wěn)定性研究計劃�;對于復溶、稀釋或混合后多次應(yīng)用的制劑��,應(yīng)開展使用中的穩(wěn)定性研究����;建議開展影響因素等試驗,以了解藥物的內(nèi)在穩(wěn)定性情況�、潛在的降解途徑,幫助穩(wěn)定性試驗條件的選擇���、分析方法的考察��。已有的穩(wěn)定性研究結(jié)果應(yīng)支持擬進行的臨床研究��,保證擬定臨床試驗期間藥品質(zhì)量的穩(wěn)定���。
☆☆I(lǐng)I/III期臨床
總結(jié)已獲得代表性批次的穩(wěn)定性試驗數(shù)據(jù);描述原料藥化學和物理敏感性�,如光敏感性�����、吸濕性等�,潛在的降解途徑���。I、II期臨床試驗通常周期較長���,而擬用于臨床試驗樣品的穩(wěn)定性考察時間很有限���,建議可提交相關(guān)的支持性研究數(shù)據(jù),例如臨床前或早期臨床試驗的處方��、工藝相似批次以及批量較小批次等的穩(wěn)定性研究結(jié)果�����。進入III期臨床后通常應(yīng)按照指導原則要求開展穩(wěn)定性試驗�����,以方便NDA的申報�����。
☆質(zhì)量部分
☆☆I(lǐng)期臨床
列出質(zhì)量標準的項目、方法和可接受限度�。建議對涉及安全性的有關(guān)物質(zhì)、遺傳毒性雜質(zhì)等檢測方法的適用性進行初步驗證�,初步界定雜質(zhì)譜;擬定限度應(yīng)基于已有批分析數(shù)據(jù)的積累�,臨床樣品的雜質(zhì)水平不得超出動物安全性試驗數(shù)據(jù)所支持的相應(yīng)雜質(zhì)的水平;提供已有批次(如安全性評價���、穩(wěn)定性試驗等)和擬進行臨床試驗批次(如有)的批分析數(shù)據(jù)��。
☆☆I(lǐng)I/III期臨床
提供分析方法部分驗證結(jié)果摘要(可列表�,如專屬性����、精密度、準確度��、線性���、定量限/檢測限等)��;繼續(xù)進行雜質(zhì)譜的鑒定����;對原料藥合成工藝變更產(chǎn)生的新雜質(zhì)和制劑中新發(fā)現(xiàn)的降解產(chǎn)物進行定性和定量研究,建議申報I�、II期臨床時確定原料藥主要雜質(zhì)以及制劑的主要降解產(chǎn)物;重新評估先前I期或II期的質(zhì)量標準和可接受限度����,根據(jù)當前的研究階段進一步評估和調(diào)整。對于難溶性口服固體制劑�����,建議積累制劑所用原料藥的粒度分布數(shù)據(jù)�,建立藥物開發(fā)早期�����、后期獲得數(shù)據(jù)與體內(nèi)療效的相關(guān)性�����;建立溶出度/釋放度方法��,結(jié)合藥物特性選擇介質(zhì)和試驗方法�����,建議對臨床前試驗樣品、各期臨床試驗樣品����、穩(wěn)定性試驗樣品的溶出/釋放行為進行考察,建立藥物開發(fā)早期�����、后期獲得數(shù)據(jù)與體內(nèi)療效的相關(guān)性���。提交各項臨床試驗樣品的批分析數(shù)據(jù)�����。
☆制劑部分
☆☆I(lǐng)期臨床
通常采用的劑型比較簡單����,例如口服制劑采用粉末裝膠囊�,或者制備成混懸液、溶液等��,以方便劑量探索���,此階段的劑型和處方工藝還存在很大的不確定性�����,不是藥學評價的重點��,重點是保證臨床試驗樣品的穩(wěn)定���、安全���。但對于無菌制劑,出于安全性的考慮����,應(yīng)提供詳細的滅菌/除菌工藝條件���,制備工藝應(yīng)能保證產(chǎn)品的無菌���。應(yīng)注意說明臨床試驗擬用制劑和毒理學試驗所用制劑在生產(chǎn)、特性方面的差異���,討論這些差異對安全性可能的影響程度���,總之�����,要保證用于臨床前動物試驗����、臨床試驗等所用藥物的質(zhì)量具有可比性���。此外要說明原料和制劑的制備過程是否顯示出任何潛在的人體風險信號���,如有,應(yīng)對這些潛在的危險信號進行分析���,闡述監(jiān)測計劃��。
☆☆I(lǐng)I/III期臨床
提交I期或II期臨床期間劑型���、處方、工藝的變化及相關(guān)研究資料���,溶出行為等質(zhì)量特性可能具有潛在臨床相關(guān)性����,請關(guān)注變更對這些質(zhì)量特性的影響,評價早期臨床試驗制劑與后續(xù)擬使用制劑的相關(guān)性�����。對于I�����、II期申報���,如已明確關(guān)鍵生產(chǎn)步驟���,應(yīng)記錄關(guān)鍵步驟的控制和中間體的控制信息。III期臨床試驗是確認藥品安全性有效性最重要的試驗部分��,I�����、II期臨床試驗所用的樣品是關(guān)聯(lián)藥品的安全有效性與產(chǎn)品質(zhì)量屬性的關(guān)鍵批次���,對于將來新藥上市申請(NDA)申報時制定全面的質(zhì)量控制體系非常重要��,建議高度關(guān)注I�����、II期臨床試驗樣品的CMC相關(guān)信息���。通常是根據(jù)擬定商業(yè)化生產(chǎn)來對 I、II期臨床樣品的生產(chǎn)和其他藥學研究工作進行合理安排��,盡量避免NDA之前再發(fā)生影響產(chǎn)品質(zhì)量的重大變更��,加強對工藝控制信息���、關(guān)鍵質(zhì)量信息的收集�����。(犬藥代動力學)

 蘇公網(wǎng)安備 32058502010454號
蘇公網(wǎng)安備 32058502010454號
